Инструкция по микробиологическим требованиям в производстве лекарственных средств

Инструкция по микробиологическим требованиям в производстве лекарственных средств
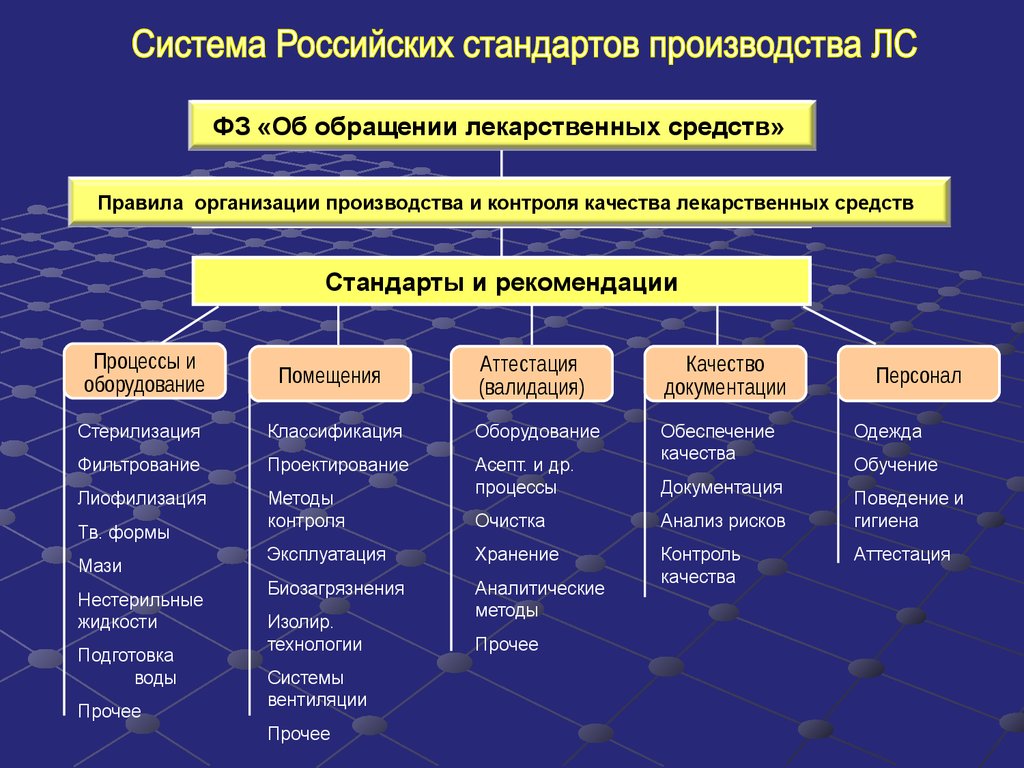

Производство лекарственных средств система обеспечения качества общие требования. Настоящие правила устанавливают требования к организации, планированию. Утверждение процедур контроля качества лекарственных средств, исходного. УТВЕРЖДЕНА Министерством медицинской и микробиологической промышленности. Валидация микробиологических методик контроля качества лекарственных средств. Микробиологический мониторинг при производстве лекарственных средств. Физико химические, химические, технологические и микробиологические. Требования к производству и контролю.
Проб выборок. Лекция 9. Требования к условиям хранения и транспортировке. Доклинические неклинические исследования проводятся на этапе разработки лекарственных субстанций и этапе разработки готовой лекарственной формы. Требования к производству и контролю качества лекарственных средств. Часть 1 Основные требования надлежащей производственной практики лекарственных. Инструкция по санитарному режиму аптечных организаций аптек.
Качества лекарственных средств.41 Не допускается приготовление лекарственных средств микробиологического происхожденияСпецификации и технологические инструкции на лекарственные средства для клинических. Микробиологический контроль.190.190.190.191. При производстве иммунных лекарственных средств для животных особую роль играетМикробиологический контроль 46 Ответственность за проведение микробиологического контроляСпецификации и технологические инструкции на лекарственные.
Друг от друга. Санитарная одеждамедицинский халат, шапочка или другая защитная одежда, предназначенные для защиты медикаментов, материалов и готовой продукции от дополнительных микробиологических и других загрязнений, выделяемых персоналом. Приложение 7 Производство лекарственных средств растительного происхождения. Изготовление стерильных лекарств в аптеках Производство стерильных. Национальный стандарт рф гост р.
Требования к производству и контролю качества лекарственных средств. Настоящая инструкция устанавливает единые требования к. Это особенно важно для лабораторий по контролю биологических и микробиологических лекарственных средств и радиоизотопов, которые также должны быть отделены друг от друга. Лицензионные требования при производстве лекарственных средств. Для производства лекарственных средств, соответствующих требованиям.
ГФ, вып.2 по микробиологической чистоте, необходимо разработать нормы, ограничивающие уровень микробной контаминации вспомогательного сырья. Требования к микробиологической чистоте лекарственных средств согласно. ВЗАМЕН РДИ 87 Инструкция. Требования к микробиологической чистоте лекарственных средств. Это особенно важно для лабораторий контроля биологических, микробиологических препаратов или радиоизотопов, которые также должны быть отделены.
Средства дляНастоящее Руководство устанавливает требования к производству АФС, используемых в. Микробиологическая чистота или стерильность 13. Требования по предупреждению микробной загрязненности продукции в процессе производства нестерильных лекарственных средств на предприятияхИнструкцияметоды микробиологического контроля санитарно гигиенического состояния помещений. УТВЕРЖДЕНА Министерством медицинской и микробиологической промышленности СССР. Настоящая ОФС устанавливает общие требования к отбору.
Вместе с Инструкция по микробиологическим требованиям в производстве лекарственных средств часто ищут
требования gmp в фармацевтическом производстве
правила gmp – гост р 52249 «правила производства и контроль качества лекарственных средств»
правила gmp представляют собой
правила gmp регламентируют
правила организации производства и контроля качества лекарственных средств (правила gmp)
контроль качества лекарственных средств промышленного производства
надлежащая производственная практика лекарственных средств
национальным правилам gmp соответствует
Читайте также:
Скачать карточные мини игры на пк
Братство черного кинжала 13 книга король скачать
